Cosa sono gli interferenti analitici
L’interferenza analitica è l’effetto di una sostanza presente in un campione che causa la deviazione del valore misurato dal valore vero.
Le più comuni interferenze nei test di patologia clinica sono date dalla presenza di:
- emolisi;
- lipemia;
- ittero.
Le sostanze interferenti sono principalmente l’emoglobina libera, i lipidi e la bilirubina, ma interferenti possono essere anche globuline e farmaci. L’effetto di queste variabili nei test di patologia clinica è spesso metodo dipendente.
Alcune sostanze interferenti (come lipidi, emoglobina libera e farmaci) sono considerate variabili pre-analitiche, poiché sono in una certa maniera controllabili e possono essere minimizzate tramite corrette procedure di prelievo e conservazione del campione.
Osservare alcune accortezze riguardo la modalità di prelievo, i tempi di digiuno del paziente, i tempi di sospensione del trattamento farmacologico, l’utilizzo di provette adeguate e la corretta centrifugazione e conservazione del campione può ridurre la probabilità di ottenere sieri alterati e aiutare in una corretta diagnosi clinica.
La misura degli interferenti analitici in IZSVe
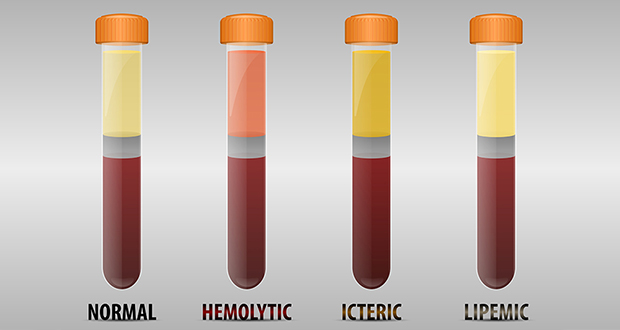
La strumentazione di chimica-clinica utilizzata presso l’U.O. di patologia clinica ed ematologia (Laboratorio di istopatologia) dell’Istituto Zooprofilattico Sperimentale delle Venezie è dotata di tecniche innovative, completamente automatizzate per la misura quantitativa degli indici di lipemia (indice L), emolisi (indice H) e ittero (indice I), complessivamente denominati “indici del siero”.
La valutazione di questi indici risulta pertanto più accurata e obiettiva rispetto ad una stima di tipo visivo. Questa misura non ha finalità cliniche o diagnostiche, ma è utilizzata per dare un giudizio oggettivo sulla qualità globale del campione in analisi. L’operatore può:
- adottare le soglie di indice d’emolisi prestabilite dal produttore o adattarle localmente per generare un avviso strumentale qualora l’indice ecceda i limiti;
- segnalare il grado di emolisi sul referto e stabilire il grado di interferenza sulle analisi richieste, onde aggiungere commenti o sopprimere il risultato.
Lipemia

La lipemia è definita come la torbidità in campioni di siero e di plasma percettibile ad occhio nudo.
La causa più frequente di lipemia è una concentrazione elevata di trigliceridi ed è generalmente un artefatto post-prandiale (sangue prelevato in animale non a digiuno). La perdita di limpidezza del plasma si verifica con un contenuto di trigliceridi di circa 250-300 mg/dL (2.8-3.4 mmol/L) ed è sempre presente quando questo supera i 400 mg/dL (4.5 mmol/L).
Può essere minimizzata prelevando il sangue da un animale a digiuno (da almeno 12 ore). La presenza di lipemia in un animale a digiuno è suggestiva di uno stato patologico, per es. diabete mellito, pancreatite, lipidosi epatica (cavalli), neoplasia (cavalli).
Test di refrigerazione
Per accertare le classi di lipoproteine che possono essere presenti in eccesso, il veterinario ambulatoriale può eseguire un semplice test di refrigerazione (Schenk P), mantenendo il campione di siero a temperatura di refrigerazione per tutta la notte.
I chilomicroni, essendo la lipoproteina meno densa, galleggiano formando uno “strato cremoso” sulla sommità del campione di siero.
- Se il siero sottostante è limpido, sono presenti in eccesso soltanto i chilomicroni e si deve sospettare che il campione non sia stato prelevato a digiuno, oppure che sia in atto un’iperchilomicronemia primaria.
- Se il siero è al di sotto dello strato dei chilomicroni è torbido, sono presenti in eccesso altre lipoproteine oltre alla iperchilomicronemia.
- Se dopo la refrigerazione non si forma uno “strato cremoso”, non sono presenti chilomicroni e l’iperlipemia visibile è dovuta ad un eccesso di altre lipoproteine.
Interferenze della lipemia nelle analisi di laboratorio
L’interferenza della lipemia dipende essenzialmente dalla strumentazione e dal metodo utilizzati e può essere:
- di tipo spettrofotometrico (aumento dell’assorbanza);
- di tipo chimico (formazione di complessi con i reagenti);
- con meccanismi di tipo fisico per spostamento di volume (aumento del volume lipofilo e anomala distribuzione di alcuni analiti).
La lipemia interferisce nei test ematologici attraverso meccanismi di dispersione della luce. Presenta un falso aumento nei risultati di emoglobina e indici emoglobina correlati misurati con metodiche in assorbanza e con la determinazione della conta piastrinica. In quest’ultimo caso infatti grosse molecole lipidiche possono essere erroneamente contate come piastrine, aumentando in maniera falsata il risultato.
Nei test di chimica clinica la lipemia genera un’interferenza, generalmente metodo-dipendente, nella lettura di alcuni analiti, quali ad esempio la bilirubina totale e gli elettroliti (soprattutto sodio e cloro, in misura minore il potassio).
Interferenze della lipemia nelle analisi IZSVe
Per quanto riguarda le metodiche utilizzate presso il laboratorio dell’IZSVe, la lipemia:
- influisce in maniera significativa con l’analisi della bilirubina totale, e nei casi di forte lipemia, il risultato viene soppresso;
- fa registrare una lieve diminuzione nei risultati di alcuni enzimi come AST e ALT;
- non ha invece alcuna influenza significativa nella valutazione della concentrazione degli elettroliti.
Emolisi

Il termine emolisi deriva dal greco haimo (sangue) e lysis (scioglimento), e definisce il processo patologico caratterizzato dalla distruzione/rottura dei globuli rossi (red blood cell o RBC) e delle altre cellule del sangue con conseguente liberazione di emoglobina e di altri componenti intracellulari nel liquido extracellulare.
In genere l’emolisi si rende palese visivamente quando la concentrazione di emoglobina libera supera 30 mg/dL (o 18,8 mmol/L), che conferisce quindi un colore rosato/rosa/rosso al campione di plasma/siero dopo la centrifugazione.
L’emolisi è generalmente un artefatto in vitro conseguente a:
- una procedura di prelievo non corretta;
- il congelamento del sangue intero;
- la separazione tardiva del siero o del plasma dalla componente cellulare;
- la consegna tardiva del campione;
- la presenza di lipemia (i globuli rossi sono infatti più fragili nei campioni lipemici e tendono a lisare più facilmente in questi campioni, anche se conservati correttamente);
- l’effetto di alcuni anticoagulanti (es. fluoro ossalato).
L’emolisi in vitro può inficiare l’attendibilità dei risultati di molti esami di laboratorio e influire negativamente sui processi diagnostici.
L’emolisi può essere anche un processo che accade in vivo (emolisi intravascolare) come risultato di meccanismi biochimici, immunologici, fisici o chimici, ad es. in presenza di anemia emolitica causata da infezione da babesia, da un reazione immunomediata o da un danno ossidativo.
La lisi dei globuli rossi in vitro può mimare l’emolisi intravascolare; in questi casi in laboratorio diventa impossibile distinguere l’emolisi in vitro da quella in vivo. In generale, se l’animale è anemico e presenta emoglobinuria, è plausibile la presenza di emolisi intravascolare.
Interferenza con i test ematologici
L’emolisi interferisce con alcuni parametri di ematologia per la lisi degli RBC e attraverso meccanismi di dispersione della luce:
- ematocrito (HCT), microematocrito (packed cell volume, PCV) , conta degli RBC: questi possono essere falsamente diminuiti poiché vi sono globuli rossi lisati;
- indici correlati all’emoglobina: poiché gli analizzatori automatici lisano gli RBC per misurare l’emoglobina, l’analisi dell’emoglobina darà lo stesso risultato sia in assenza che in presenza di emolisi (in vivo o in vitro). Il risultato dell’emoglobina sarà pertanto, in proporzione, relativamente più alto rispetto all’HCT e agli RBC; quindi gli indici calcolati MCH e MCHC risulteranno falsamente più alti. L’MCV, quando misurato direttamente dall’analizzatore (come nel caso del laboratorio dell’IZSVe), non risentirà dell’interferenza da emolisi, a meno che non sia calcolato dal valore di ematocrito, nel qual caso andrà eliminato;
- conta piastrinica: le ombre eritrocitarie possono essere erroneamente contate come piastrine, incrementando falsamente il risultato.

L’emolisi interferisce con alcuni parametri di ematologia per la lisi degli RBC e attraverso meccanismi di dispersione della luce. Può interferire inoltre in maniera significativa con gli analizzatori biochimici.
Interferenza nei test chimici
L’emolisi può interferire inoltre in maniera significativa con gli analizzatori biochimici, principalmente sulla base dei seguenti meccanismi:
- rilascio di costituenti nello spazio extracellulare: il rilascio di costituenti o enzimi che si trovano a elevate concentrazioni all’interno dei globuli rossi porta a un falso aumento del valore di questi test (ad es. potassio nei cavalli ed in alcune razze asiatiche di cani, AST, LDH, magnesio e ferro). Anche l’analisi del fosforo inorganico può aumentare con l’emolisi in quanto i fosfati organici vengono convertiti nel tempo ad inorganici;
- interferenza spettrofotometrica nella reazione: molte reazioni chimiche sono basate sulla misurazione del cambiamento dell’assorbanza ad una lunghezza d’onda attorno a quella di assorbimento dell’emoglobina (es. GGT);
- interferenza di tipo chimico: rilascio di costituenti intracellulari che interferiscono direttamente o indirettamente con la misurazione dell’analita, come per esempio l’adenilato ciclasi rilasciata dagli eritrociti, che aumenta l’attività della creatin chinasi (CK) sierica;
- rilascio di acqua: il rilascio dell’acqua contenuta all’interno degli RBC diluisce i costituenti sierici. A livelli di emolisi molto elevata alcuni costituenti come albumina, glucosio, sodio e cloro possono risultare diminuiti per effetto di questa diluizione.
Interferenza con l’elettroforesi delle sieroproteine
L’emoglobina e il complesso emoglobina-aptoglobina migrano nella regione delle beta-globuline, portando ad un aumento di questa frazione di sieroproteine. In presenza di emolisi severa, l’aumento può essere confuso con un picco monoclonale di immunoglobuline.
Interferenze dell’emolisi nelle analisi IZSVe
Nella tabella qui sotto sono riportate le principali interferenze da emolisi, con indicazione di aumento o diminuzione del risultato analitico, rispetto ai metodi utilizzati presso il laboratorio dell’IZSVe.
| Analita | Grado di emolisi | ||
| Lieve H < 50 |
Moderata 50<H<110 |
Elevata H>110 |
|
| Potassio (K) | ↑ | ↑ | ↑↑ |
| Lattato Deidrogenasi (LDH) | ↑ | ↑↑ | ↑↑↑ |
| Aspartato Aminotransferasi (AST) | – | ↑ | ↑↑ |
| Alanina Aminotransferasi (ALT) | – | ↑ | ↑↑ |
| Fosfatasi Alcalina (ALP) | – | – | ↓ |
| Bilirubina coniugata (Bil D) | – | – | ↑ |
| Creatina kinasi (CK) | ↑ | ↑↑ | ↑↑↑ |
| Ferro (Fe) | – | ↑ | ↑↑ |
| γ-glutamyl-transferasi (GGT) | – | ↓ | ↓↓ |
| Ferritina | – | – | ↑ |
| UIBC | – | ↑ | ↑↑ |
| Magnesio (Mg) | – | – | ↑ |
| Fosforo (P) | – | – | ↑ |
| Amilasi | – | – | ↓ |
È però importante sottolineare che, per alcuni parametri, l’effetto dell’emolisi nel risultato dei test è specie-dipendente, in quanto ci possono essere differenze significative nel contenuto di sostanze o enzimi intraeritrocitari. A questo proposito è possibile leggere questo articolo pubblicato da ricercatori dell’Istituto Zooprofilattico Sperimentale delle Venezie sull’interferenza dell’emolisi in campioni di sangue di suino: Di Martino et al. (2015).
Ittero
L’ittero è definito come un livello elevato di bilirubina totale (coniugata e non coniugata) nel siero e nel plasma.
Un artefatto, cioè un aumento dell’indice di ittero non corrispondente ad una reale iperbilirubinemia, può essere presente in alcune specie animali, con dieta ricca di caroteonidi (ad esempio, ruminanti e avicoli).
L’ittero ha un effetto nei risultati dei test ematologici e biochimici mediante interferenza di tipo spettrofotometrico o chimico.
Interferenze dell’ittero nelle analisi IZSVe
Con le metodiche applicate nel laboratorio IZSVe, la presenza di ittero porta:
- una diminuzione dei risultati della creatinina;
- in misura minore, una diminuzione delle proteine totali, del colesterolo e della GGT.
Un falso aumento può esser registrato in caso di ittero nella concentrazione del fosforo (se la componente che contribuisce all’ittero è la bilirubina coniugata).
Per approfondire
- Kroll M, Elin, R. Interference with Clinical laboratory Analyzes. Clin Chem 1994; 40: 1996-2005
- Lippi G et al. Raccomandazioni di consenso SIBioC-SIMeL per la rilevazione e gestione dei campioni emolisati e utilizzo dell’indice di emolisi. Biochimica Clinica, 2011;35(6):481-490
- Schenck P. L’iperlipemia nel cane: cause e trattamento nutrizionale. In: Nutrizione Enciclopedia della nutrizione clinica del cane, IVIS website
- Selby C. Interference in immunoassay. Ann Clin Bioch 1999;36:704-21.
- Thomas L. Haemolysis as influence and interference factor. EJIFCC 2002;13:1–4.
 IZSVe Pets Ricerca e servizi ai medici veterinari per gli animali da compagnia
IZSVe Pets Ricerca e servizi ai medici veterinari per gli animali da compagnia


![Come contrastare l’avvelenamento degli animali? [Video]](https://www.izsvepets.it/wp-content/uploads/2023/04/come-contrastare-avvelenamento-animali-video-300x160.jpg)


